T-box核糖开关是重要的基因调控元件,广泛分布于结核杆菌、皮疽诺卡菌等革兰氏阳性菌中。其核心功能是通过识别tRNA 3΄末端的氨酰化状态,感知细菌营养水平,进而精准调控相关基因表达,对维持细菌生长平衡具有重要作用。由于该元件在细菌中普遍存在,但在哺乳动物中尚未发现,因而针对T-box核糖开关的药物设计已成为新型抗生素研发的重要方向。目前,T-box的功能实现高度依赖其三维结构与构象动态特征,已有研究解析了多种T-box-tRNA复合物的静态三维结构,但学界对T-box如何精准鉴别不同氨酰化状态的tRNA,并启动后续转录和翻译调控的构象动态机制尚不明晰。
近日,中国科学院生物物理研究所等,首次运用单分子荧光共振能量转移(smFRET)技术,系统探究了结核分枝杆菌ileS T-box核糖开关的结构动态,揭示了其在共转录水平鉴别tRNA 3΄末端氨酰化状态、调控翻译起始过程的分子机制,为深入理解RNA-RNA相互作用的功能机制及新型抗生素开发提供了重要理论支撑。
研究团队在T-box核糖开关的适配体与鉴别结构域筛选了多对标记位点,结合自主开发的RNA定点荧光标记技术与smFRET技术,系统观测了不同氨酰化状态tRNA结合诱导的T-box结构转变。结果显示,T-box通过“构象选择”机制,实现了对tRNA的两步精准识别。第一步为“身份识别”,tRNA反密码子区与T-box解码结构域结合,促使Stem I/II形成稳定“对接构象”,并同时触发鉴别结构域折叠,为后续氨酰化状态感知做好准备。第二步为“氨酰化状态感知”,若tRNA未负载氨基酸,其3΄末端与鉴别结构域稳定结合,使开关维持“AntiS”构象,暴露SD序列并启动下游基因翻译;若tRNA已负载氨基酸,则诱导鉴别结构域中Stem III与linker区域呈现高度柔性,促使构象转变为“Sequestrator”,隐藏SD序列,以抑制翻译。
突变实验证实,连接适配体与鉴别结构域的linker区域是感知tRNA氨基酸状态的关键结构单元,且关键碱基突变会导致T-box丧失对tRNA氨酰化状态的响应能力。为进一步探讨共转录过程对T-box调控机制的影响,研究团队制备了模拟不同转录中间产物的不同长度T-box截短体及荧光标记的共转录T-box/tRNA复合物,并开展了smFRET实验。结果表明,T-box对tRNA NCCA末端的识别具有明显的转录依赖性。这一“共转录调控”特性,使T-box能够快速响应细胞内氨基酸水平变化,实现基因表达的高效精准调控。
这一研究提出了T-box核糖开关的共转录调控模型,阐明了其在转录过程中分步识别tRNA、鉴别氨酰化状态、动态切换构象并最终调控基因表达的完整动态过程。
相关研究成果发表在《自然-通讯》(Nature Communications)上。研究工作得到国家自然科学基金委员会、科学技术部、中国科学院、清华大学等的支持。
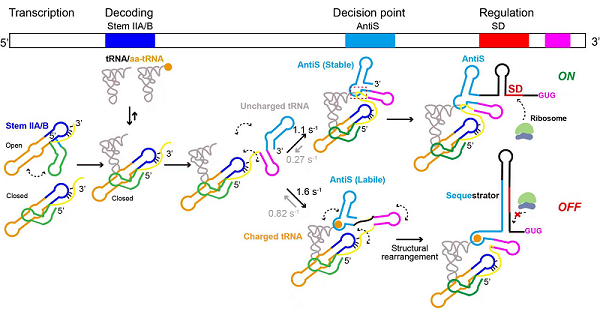
T-box核糖开关在共转录水平上调控基因表达的模型
供稿人:杨越
审核人:文成锋




