极端低氧胁迫可导致糖脂代谢紊乱,使机体产生供能障碍,进而打破机体的内环境稳态。这种稳态严重失衡,会危及生命。那么,青藏高原动物如何通过调控糖脂代谢平衡,维持充足能量供应,从而适应在极端低氧环境生存需求的?近日,中国科学院动物研究所研究团队,利用隼型小鼠模型破解了青藏高原动物维持糖脂代谢稳态的新机制。
此前,研究团队在快速拓殖并适应青藏高原环境的猎隼中,发现了变异的“明星”基因——EPAS1。该基因作为低氧诱导因子,在物种适应高原低氧环境过程中发挥重要作用。EPAS1既参与糖代谢调节,也参与脂代谢调节。因此,研究团队利用CRISPR-Cas9基因编辑技术,构建了携带猎隼EPAS1基因突变的隼型小鼠模型,以探究低氧下的糖脂代谢调控模式。
研究团队将隼型小鼠和野生型小鼠置于10%O2浓度的慢性低氧环境中(相当于海拔5000米以上),并利用呼吸交换率(RER)评估小鼠在低氧下的糖脂代谢偏向性。结果显示,经低氧处理,隼型小鼠的RER值没有显著波动,而野生型小鼠的RER值在低氧处理后显著降低,这说明隼型小鼠在低氧下具有维持糖脂代谢平衡的能力。研究团队进一步通过分子与细胞实验、肝脏代谢组学和转录组学整合分析,揭示了该现象背后的遗传学机制。由于隼型EPAS1蛋白与伴侣蛋白ARNT的亲和力下降,与调节其降解的pVHL蛋白的作用增强,从而降低了隼型EPAS1蛋白的活性,钝化了低氧反应。
这一功能改变,影响了下游糖脂代谢相关基因和代谢物的表达,使隼型小鼠在低氧下的葡萄糖、脂肪酸等主要代谢物更快恢复至常氧水平,有效避免了因代谢失衡导致的单一能量底物过度消耗或异常堆积。隼型小鼠这种更具优势的糖脂代谢模式,在青藏高原野生猎隼种群中也得到了验证。研究团队提出了呼吸、摄食、运动等行为可塑性对低氧下维持糖脂代谢稳态的重要贡献。隼型小鼠在低氧下维持糖脂代谢稳态具有重要进化意义,即体重在低氧下恢复的更快,体内的氧化应激反应更低。同时,在4%O2浓度的急性低氧环境下,隼型小鼠的生存时间比野生型小鼠更长,生存率也更高。
该研究通过对低氧胁迫下跨物种基因的糖脂代谢稳态遗传机制研究,实现了从基因转录到代谢,从细胞到个体,从模式动物到野生动物的高原低氧适应代谢研究系统。团队下一步将推动糖脂代谢调控系统应用于疾病诊疗和药物研发。
近期,相关研究成果发表在《自然-通讯》(Nature Communications)上。研究工作得到国家自然科学基金委员会、中国科学院、英国皇家学会等的支持。
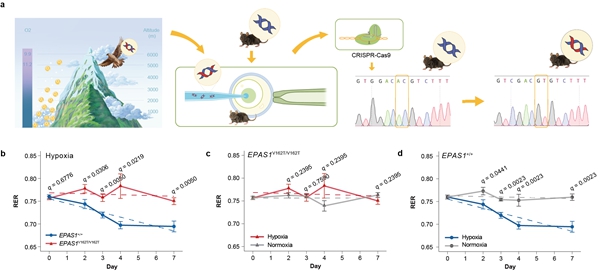
隼型小鼠模型构建及其在低氧下的生理表征
供稿人:杨越
审核人:文成锋




